|
||||||||||||||
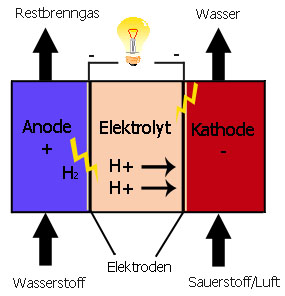
Die Elektroden müssen
eine hohe Porosität aufweisen, damit eine große Oberfläche
für die elektrochemischen Umsetzungen zur Verfügung steht.
Sie werden mit einer dünnen, katalytisch wirkenden Edelmetall-Schicht
überzogen. Als Katalysatoren-Materialien werden meist Platin oder
Platin-Legierungen verwendet, da die Membran stark sauren Charakter
aufweist (vergleichbar mit Schwefelsäure) und niederwertige Metalle
angreifen würde. Diese technische Eigenschaft ist auch der Grund warum Platin auf dem Weltmarkt knapp ist und der Platin Preis kontinuierlich ansteigt. Der Kraftstoff wird durch Graphitplatten (Bipolar-Platten)
zugeführt, in die feine Gänge gefräst sind. Durch diese
Gänge wird auf der einen Seite Wasserstoff und auf einer anderen
Seite Luft bzw. Sauerstoff zugeführt. Auf der Anoden-Seite
muss die Membran befeuchtet und auf der Kathoden-Seite muss das Reaktionsprodukt
Wasser entfernt werden. Gleichzeitig muss die Wärme aus dem Stapel
abgeführt und soweit möglich nutzbar gemacht werden. |
||||||||||||||
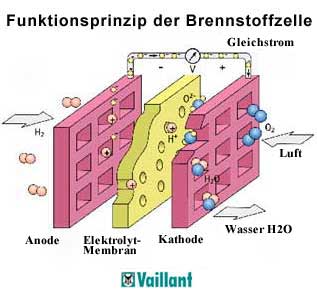
Der an der Anode zugeführte
Wasserstoff teilt sich mit Hilfe des Katalysators in Elektronen (negative
Ladungsträger) und Protonen (positive Wasserstoff-Ionen). Die freien
Elektronen werden als elektrischer Strom durch die Elektrode in den
äußeren Strom-Kreislauf geleitet. Die Protonen diffundieren
durch die Elektrolyt-Membran zur Kathode. Obwohl die Protonen größer
sind als die Elektronen, gelangen keine Elektronen durch diese Membran.
Dies kommt durch den Säuregrad des Elektrolyten. Es hat damit chemische
Gründe und ist unabhängig von den Größen-Verhältnissen.
Die negativ geladenen Elektrolyt-Ionen leiten das Proton weiter, wobei
die Ionen selber ortsfest bleiben. Die negativen Elektronen hingegen
werden abgestoßen und müssen den langen Weg außen herum
nehmen. Auf der anderen Seite an der Kathode rekombinieren die Sauerstoff-Ionen
aus der Luft, die Elektronen aus dem Strom-Kreislauf sowie die H2-Protonen
und erzeugen unter Wärme-Entwicklung Wasser. maxgym.musin Anmerkungen * Genauer - die freie Enthalpie ** Genauer wird der Zwischenschritt nur für den elektrischen Anteil vermieden. Für diesen gilt die Carnot-Oberschranke nicht. Für den thermischen Anteil gelten weiterhin die Obergrenzen des Carnot-Prozesses. In Summe (elektrisch + thermisch) kann dann ein höherer Wirkungsgrad erreicht als der maximal mögliche eines Carnot-Prozesses mir reiner Verbrennung ohne direkte Umwandlung in elektrische Energie. |
||||||||||||||
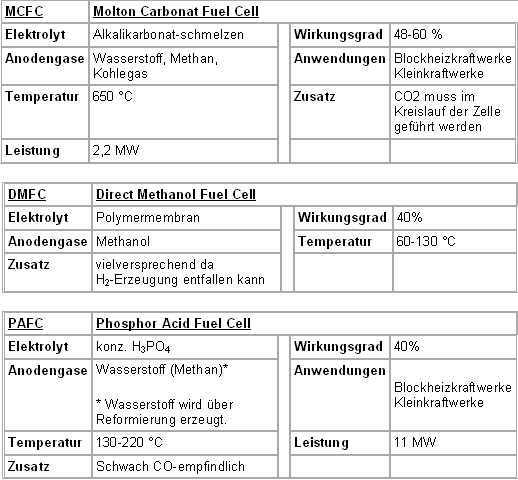
Brennstoffzellentypen
|
||||||||||||||
|
||||||||||||||
 |
||||||||||||||
|
||||||||||||||
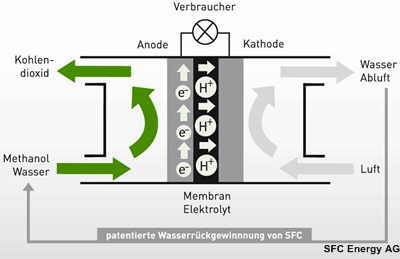
Klein-Brennstoffzelle |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Brennstoffzelle
- dieBrennstoffzelle.de |
||||||||||||||
Technologie
der EFOY-Brennstoffzellen - SFC Energy AG |
Brennstoffzelle - Erklärung und Funktion
- Computer:Club2 |
Hinweis!
Schutzrechtsverletzung: Falls Sie meinen, dass von meiner Website
aus Ihre Schutzrechte verletzt werden, bitte ich Sie, zur Vermeidung
eines unnötigen Rechtsstreites, mich
umgehend bereits im Vorfeld zu kontaktieren, damit
zügig Abhilfe geschaffen werden kann. Bitte nehmen Sie zur Kenntnis:
Das zeitaufwändigere Einschalten eines Anwaltes zur Erstellung
einer für den Diensteanbieter kostenpflichtigen Abmahnung entspricht
nicht dessen wirklichen oder mutmaßlichen Willen. Die Kostennote
einer anwaltlichen
Abmahnung ohne vorhergehende Kontaktaufnahme mit mir wird daher im Sinne
der Schadensminderungspflicht als unbegründet zurückgewiesen. |