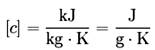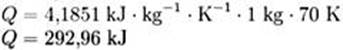Aus den Elementen Sauerstoff (O) und Wasserstoff (H) entsteht die chemische Verbindung "Wasser" (H2O). Unter dem Begriff "Wasser" versteht man allgemein den flüssigen Aggregatzustand1. Aber Wasser gibt es auch im festen (gefrorenen) Zustand (Eis) und im gasförmigen Zustand (Wasserdampf bzw. Dampf). Neuerdings wird auch von einem gelartigen Zustand des Wassers gesprochen. Dieser Zustand bildet sich natürlicherweise an allen wasserliebenden Grenzflächen (z. B. zwischen Wasser und Luft oder auch überall in unserem Organismus an Zellmembranen, Blutgefäßen)..
Wasser hat besondere Stoffeigenschaften gegenüber anderen Flüssigkeiten.
• Wasser hat bei +4 °C die höchste Dichte (Anomalie2)
• Wasser hat die größte Oberflächenspannung aller Flüssigkeiten (in feuchter Luft 72 mN/m bei +20 °C [außer Quecksilber 435 mN/m]).
• Wasser hat die höchste Wärmekapazität3 aller Flüssigkeiten (4,187 kJ/(kg·K)
• Wasser hat eine sehr geringe Wärmeleitfähigkeit (guter Wärmespeicher)
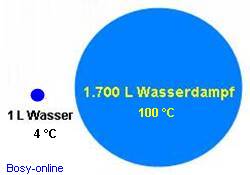
• Wasser hat die größte Verdampfungwärme bzw. Verdampfungsenthalpie4 aller Flüssigkeiten (2257 kJ/kg) und eine hohe Schmelzenthalpie5(334 kJ/kg)
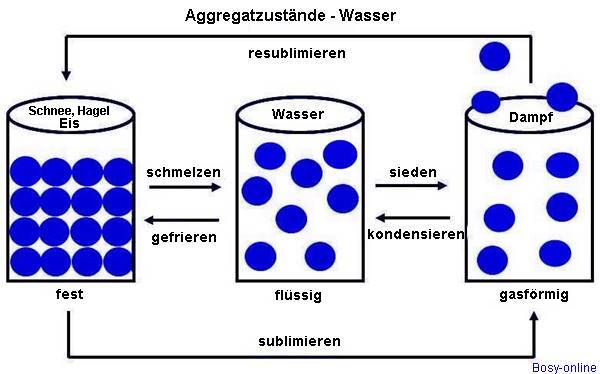
1 Aggregatzustand von Wasser - In der Natur ist Wasser der einzige Stoff, der in allen drei Aggregatzuständen vorkommt (fester Zustand [Schnee, Hagel, Eis], flüssiger Zustand [Grund-, Oberflächen- und Regenwasser} und gasförmiger Zustand [Wasserdampf in der Luft]). Aggregatzustand einfach erklärt Plasma wird als "vierter" Aggregatzustand bezeichnet. Wenn mit steigender Temperatur alle Stoffe gewöhnlich nacheinander vom festen in den flüssigen und dann in den gasförmigen Zustand übergehen, entsteht bei weiter steigender Temperatur und steigendem Druck ein Plasma. Das ist ein Stoff, dessen Bestandteile teilweise oder vollständig in Ionen und Elektronen aufgeteilt sind. Plasma lässt sich durch starkes Erhitzen von gasförmigen Stoffen oder mithilfe von elektrischen Feldern erzeugen und hat eine hohe elektrische Leitfähigkeit.
In der Technik gibt es einige Anwendungen, in denen Plasma erzeugt wird (z. B. Gasentladungslampe [Leuchtstoffröhren, Energiesparlampen]), in denen ein gasförmiger Stoff (z. B. Quecksilberdampf, Neon, Argon) durch elektrische Spannung ionisiert. Die Plasmaphysik beschäftigt sich mit den physikalischen Eigenschaften von Plasmen In der Biologie wird unter dem Plasma das Protoplasma verstanden, die Zellflüssigkeit mit ihren kolloidalen Bestandteilen, Proteinen, Kohlenhydraten, Fetten, usw. Das Protoplasma wird in Zytoplasma und Karyoplasma unterteilt.
Dichteanomalie bedeutet, dass sich die Dichte von Wasser anders verhält als sich die Dichte von Stoffen normalerweise verhält. Normal ist, je niedriger die Temperatur, desto größer ist die Dichte. Wasser hat die größte Dichte allerdings bei 4 °C. Eis hat eine deutlich geringere Dichte als Wasser und schwimmt deshalb an der Wasseroberfläche. Die geringe Dichte ergibt sich aus der Kristallstruktur des Eises. Die Wassermoleküle sind weiter voneinander entfernt als beim Wasser im flüssigen Zustand. Anomalie des Wassers
Die Gleichung, um Wärme, Masse, Temperaturänderung und spezifische Wärmekapazität in Zusammenhang zu bringen, ist: dabei ist Q die Wärme, die der Materie zugeführt oder entzogen wird, m ist die Masse der Substanz (in kg), c ist die spezifische Wärmekapazität (in kJ·kg-1·K-1) und ΔT ist die Temperaturänderung (in K). Wärmekapazität - Hans-Peter Willig, ChemieSchule
Verdampfungswärme - Hans-Peter Willig, ChemieSchule
Die Verdampfungsenthalpie kann in einen Anteil, der die Änderung der inneren Energie ΔU in Form geänderter Bindungsenergie bewirkt, und in einen Anteil der die Volumenänderung zur Folge hat, aufgeteilt werden.
Die Summe aus innerer Energie und dem Produkt aus Druck und Volumen wird in der Thermodynamik auch als Enthalpie bezeichnet. Die Gleichung gibt somit die Änderung der Enthalpie des Stoffes durch die isobare Zufuhr der Verdampfungswärme wieder. Die Verdampfungswärme wird deshalb auch als Verdampfungsenthalpie bezeichnet.
Die insgesamt zuzuführende Verdampfungswärme für 1 Kilogramm Wasser beträgt gemäß Literatur 2257 kJ. Somit entfallen bei einem Umgebungsdruck von 1 bar folglich rund 7,5 % der insgesamt zugeführten Verdampfungswärme auf die Energie, die zur Vergrößerung des Volumens aufzuwenden sind. Die restlichen 92,5 % der Verdampfungswärme werden dann tatsächlich für die Änderung der Bindungsenergie (Änderung der inneren Energie) genutzt.
Schmelzwärme |
||
Da Wasser für uns Menschen (über)lebensnotwendig ist, ist es das
wichtigste Gut der Erde. 70 % der Erdoberfläche ist von Wasser bedeckt. Aber 97,5 % ist Salzwasser
in den Meeren und Ozeanen. Nur ca. 1 % des weltweiten Süßwasservorkommens ist nur für den Menschen als
Trinkwasser nutzbar, kann zur Versorgung in der Tierhaltung und zur Herstellung von Produkten
verwendet werden. Der größere Teil ist als Eis an den Erd-Polen vorhanden. Der nachhaltiger Umgang mit Wasser ist besonders wichtig Wasser - CHEMIE.DE, LUMITOS AG
|
Wasserarten
Wasser wird je nach Gewinnung und Verwendung anders bezeichnet.
Trinkwassergewinnung:
• Oberflächenwasser / Tagwasser
• Grundwasser (Brunnenwaser)
• QuellwasserWasser zum Trinken:
• Trinkwasser (Kaltwasser und erwärmtes Trinkwasser [Warmwasser])
• Leitungswasser (Kaltwasser und erwärmtes Trinkwasser [Warmwasser])
• Osmosewasser
• Tafelwasser
• MineralwasserWeitere Wasserarten:
• Betriebswasser (Brauchwasser - Nutzwasser)
• Prozesswasser
• Regenwasser
• Meerwasser
• Süßwasser
• Salzwasser
• Brackwasser
• Abwasser (Schmutzwasser [Schwarz- und Grauwasser] - Industrieabwasser - Fremdwasser - Regenwasser)
• Tauwasser
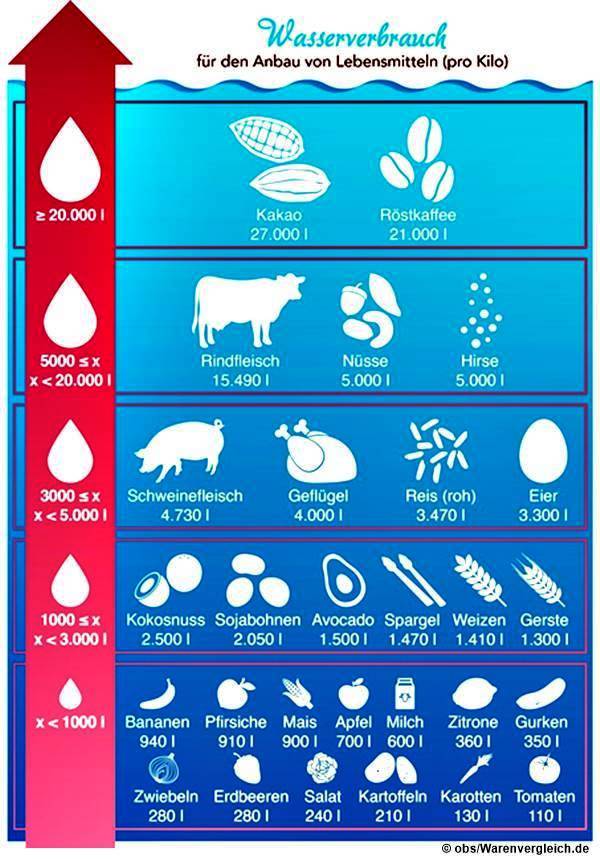
• Virtuelles Wasser
Quelle: SHKwissen - BitSign GmbH
Wasserfussabdruck |
Das virtuelle Wasser (indirekter Wasserverbrauch) kommt nicht aus der
Wasserarmatur einer Trinkwasserinstallation. Nein, es versteckt sich in der Nahrung, Kleidung und in den Gegenständen, die wir ge- oder verbrauchen. Es ist der Hauptanteil des Wasserfussabdrucks. Da Wasser für uns Menschen (über)lebensnotwendig ist, ist es das wichtigste Gut der Erde. 70 % der Erdoberfläche ist von Wasser bedeckt. Aber 97,5 % ist Salzwasser in den Meeren und Ozeanen. Nur ca. 1 % des weltweiten Süßwasservorkommens ist nur für den Menschen als Trinkwasser nutzbar, kann zur Versorgung in der Tierhaltung und zur Herstellung von Produkten verwendet werden. Der größere Teil ist als Eis an den Erd-Polen vorhanden. Deswegen ist ein nachhaltiger Umgang mit Wasser besonders wichtig. Ein Beispie:
|
Das meiste verwendete Wasser wird virtuell (also nicht wirklich) verbraucht und wird später wieder dem natürlichen Wasserkreislauf zugeführt. Auch wenn die verfügbare Süßwassermenge fast konstant bleibt, kann es aufgrund der immer mehr exportierte Produkte, besonders aus den Entwicklungsländern, zu Problemen führen. Das verbrauchte Wasser wird besonders in trockenen Gebieten dem Grundwasservorkommen entnommen, verbraucht so Grundwasserreserven, fehlt dann der heimischen Landwirtschaft und den Menschen vor Ort als trinkbares Süßwasser. Dazu kommt, dass dort besonders wasserintensive Produkte (Kaffee, Kakao, Reis, Baumwolle) angebaut werden. Außerdem bereitet das graue Wasser große Probleme, weil große Wassermengen verschmutzt werden und das sich nicht mehr vollständig bzw. nur mit hohen Kosten wieder reinigen lässt.
Täglicher Wasserverbrauch: Fast ein Drittel geht auf das Konto der WC-Spülung Wasserfußabdruck |
Unterirdische Gewässer und eiszeitliche Rinnen
Unterirdische Gewässer (Flüsse und Seen) entstehen durch versickerndes Niederschlagswasser und auch im Umkreis von Flüssen (Fließgewässer), Seen und Meeren durch Eindringen von Oberflächenwasser in den Boden. Diese sammeln sich über einer undurchlässigen Schicht (Grundwasser) an. In Karstgebieten (Karst) bilden sich auch unterirdische Flüsse und Seen in Höhlen.
Faszination unterirdische Seen
Tanja Seufert, Atlis AG
Wie die "grünen Inseln" mitten in der Wüste entstehen
ARD alpha
Wo Flüsse verschwinden
Ernst Klett Verlag GmbH
Der unsichtbare Fluss
Längengrad Filmproduktion GmbH
Eiszeitliche Rinnen (Buried Valleys) sind eine besondere Art von Trinkwasserspeicher, die während der Eiszeit entlang der Nordseeküste entstanden sind. Dies sind verborgene Rinnen, die bis zu 500 Meter in der Tiefe sein können und riesige Mengen Grundwasser aufbewahren. Dieses Wasser wird in der Zukunft aufgrund des immer häufiger auftretenden Trockenzeiten bzw. fehlenden versickernden Regenwassers immer wichtiger für die Trinkwasserversorgung.
>>>> ausführlicher - Eiszeitliche Rinnen <<<<
Videos aus der SHK-Branche |
SHK-Lexikon |
.gif) .
.